Daniele Besomi 1
Il polline è una delle due fonti alimentari delle colonie di api: mentre il nettare, con le sue sostanze zuccherine, fornisce l’energia alla famiglia, il polline apporta le proteine necessarie alla crescita delle larve. Entrambe le sostanze sono lavorate dalle api, e possono essere conservate anche per parecchio tempo.
Le scorte di polline raccolte in autunno, in particolare, servono alla colonia per riprendere la covata alla fine dell’inverno, in anticipo sulle prime fioriture; ma anche durante la stagione produttiva è necessario predisporre delle riserve per poter continuare a nutrire le larve quando, a causa della pioggia, non si può importare polline fresco. Le scorte di polline, però, sono meno abbondanti di quelle di miele. Le api devono dunque regolare la covata sulla base di quanto l’importazione corrente di polline, sommata alle scorte, permette di allevare. Pochi giorni di pioggia sono già sufficienti a ridurre drasticamente le scorte, con conseguenze piuttosto serie sulla covata. Questo fenomeno è conosciuto da tempo, anche se solo recentemente si è appurato il modo specifico con il quale le api reagiscono a serie carenze di polline. Uno studio condotto a Liebefeld ha permesso di mostrare che se si impedisce alle api di bottinare, dopo circa una settimana —cioè quando sono esaurite le scorte— la covata diminuisce rispetto a quella delle famiglie che hanno accesso regolare al polline, per fermarsi completamente dopo due settimane circa. Corrispondentemente, allo sfarfallamento diminuisce anche il numero di api adulte.
I ricercatori hanno notato che il peso e il contenuto proteico delle larve che sopravvivono non cambia di molto rispetto a quello delle larve ben nutrite, mentre cala invece il peso delle api adulte delle famiglie senza accesso al polline: una volta esaurite le scorte, le nutrici passano alle larve le proprie riserve personali, accumulate nel corpo grasso. La conclusione dei ricercatori è che le api regolano il numero di larve in modo tale che le sopravvissute non soffrano di carenze proteiche.2
Uno studio austriaco ha mostrato come avviene il processo di selezione: quando il polline inizia a scarseggiare le nutrici dapprima iniziano a limitare le visite alle larve, in particolare le più giovani, riducendo dunque la quantità di proteine che ricevono.3
Questo cambiamento di comportamento è visibile già dal primo giorno di pioggia.4
Poi, se la scarsità persiste e man mano che si riducono le scorte, le api iniziano a cannibalizzare le larve più giovani (da 1 a 3 giorni) e riciclare le proteine per nutrire le larve più vecchie, cioè quelle nelle quali hanno investito maggiormente e che hanno più probabilità di sopravvivere. Dopo 5 giorni di pioggia intensa, la mortalità delle larve raggiunge il 68%. Le celle vengono opercolate 6 ore in anticipo per mettere al sicuro le pupe.5
La regina, invece, almeno per qualche tempo continua a deporre regolarmente, 6 in modo che non appena il tempo torna al bello le api possano immediatamente iniziare ad allevare le larve appena schiuse, guadagnando così 3 giorni. Sono dunque le api, non la regina, a regolare la covata. Questi cambiamenti sono facilmente visibili anche dagli apicoltori quando ispezionano le api dopo un periodo prolungato di maltempo, come accade spesso in primavera.
Sono invece più subdoli gli effetti di scarsità di polline meno gravi, che non obbligano le api a bloccare la covata ma che sono gestite diminuendo la quantità di nutrimento proteico distribuito a ciascuna larva.
Queste condizioni possono insorgere in seguito a fattori meteorologici che riducono il tempo di volo o a carenze stagionali, ma anche per questioni gestionali, come per esempio l’uso di trappole per il polline in periodi in cui comunque le api non trovano molto oppure per l’eccessiva concentrazione di apiari che aumenta la concorrenza anche quando le risorse non sono abbondanti (v. articolo sulla densità degli apiari nel Luganese nel numero di aprile 2018 de L’Ape).
In queste condizioni, nonostante lo sforzo delle api di aumentare l’importazione impiegando una maggior percentuale di bottinatrici nella raccolta di polline 7 e dedicando più tempo alla raccolta e meno al riposo, 8 l’apporto di polline può diminuire oppure le api sono costrette a scegliere qualità di polline inferiori.
Quando possono, le api sembrano raccogliere preferenzialmente polline di elevata quantità e con adeguata diversità, ma se le risorse all’esterno sono scarse le bottinatrici sono limitate nella scelta. Gli effetti di queste condizioni di scarsità sono difficilmente visibili anche per gli apicoltori più attenti perché si manifestano in sottili alterazioni morfologiche e comportamentali e in una ridotta capacità immunitaria delle api. Si tratta di cambiamenti spesso troppo piccoli per essere percepiti ma ciò nondimeno molto significativi per il funzionamento della colonia.
La letteratura recente ha iniziato a riflettere proprio su questi effetti, in particolare dopo l’esplosione della sindrome da collasso delle colonie. Provo a farne una rassegna, per forza di cose molto sommaria. Uno studio su colonie operative, fatto a partire da api della medesima famiglia (evitando dunque di confrontare api con patrimonio genetico diverso che potrebbe introdurre delle alterazioni indesiderate nelle misurazioni) ha rilevato una serie di mutazioni fisiologiche e comportamentali. Sono state allevate, e contrassegnate individualmente per poterne seguire l’attività, api in condizione di scarsità e abbondanza di polline, in famiglie poi riunite e poste in un’arnia di osservazione. Mentre le larve sono state soggette a restrizioni nel cibo, dopo lo sfarfallamento le adulte hanno avuto tutto il polline che desideravano.
Al momento dello sfarfallamento, le neonate allevate da larve in condizioni di scarsità di polline sono visibilmente più piccole e più leggere (tra 8 e 37% di peso in meno rispetto alle loro sorellastre allevate senza restrizioni); la loro vita adulta è durata tra 5 e 18 giorni meno delle sorellastre, vale a dire una diminuzione del 21–56% della durata di vita. Per quanto riguarda il comportamento, le api da larve allevate in condizioni di scarsità bottinano meno delle sorellastre: solo il 62% delle api nate da larve con poco polline sono diventate bottinatrici, contro l’80% delle sorellastre; hanno iniziato a bottinare 2–5 giorni prima, e la loro attività di volo è durata 1–3 giorni in meno; il primo giorno di volo ne sono andate perse il 30%, contro un 13–15% delle sorellastre non rientrate nell’arnia. Anche l’attività di danza è stata meno soddisfacente: solo il 9% delle bottinatrici nate da larve scarse di polline hanno danzato, contro il 21–24% delle sorellastre ricche di polline; anche se la densità delle danze effettuate è stata grossomodo la stessa, quelle a corto di polline hanno effettuato danze molto meno precise delle altre. In conclusione, carenze di polline allo stadio larvale compromette in modo definitivo lo sviluppo e la capacità lavorativa delle api adulte, anche se ricevono polline in seguito. Naturalmente se continua a mancare il polline e neanche da adulte le api ne hanno a sufficienza la situazione peggiora ulteriormente. In ogni caso, api inefficienti ricreano il problema, perché non sono in grado di raccogliere abbastanza polline per la generazione successiva di larve. 9
Altri studi mettono in relazione la quantità di polline a disposizione della nutrici e lo sviluppo delle ghiandole ipofaringee.
Questi organi sono importantissimi per la nutrizione della colonia, in quanto sono responsabili della capacità di produrre pappa reale, nutrimento sia della regina che delle larve nei primi tre giorni di vita. Gli esperimenti sono effettuati su api neonate in gabbia, nutrite solo con zucchero, oppure con diversi tipi di polline uniflorale di cui si conosce la composizione proteica, o ancora con una miscela di pollini. Le api nutrite solo con sciroppo hanno una durata di vita più breve, e anche uno sviluppo nettamente minore delle ghiandole ipofaringee rispetto alle larve nutrite con pollini. Tra queste ultime, più è alto il contenuto di aminoacidi del polline, tanto maggiore è lo sviluppo delle ghiandole; le miscele di polline danno sempre buoni risultati.10
I ricercatori hanno anche notato che quando si offrono i medesimi tipi di polline a api in colonie libere, l’ordine di preferenza è il medesimo dell’ordine con cui crescono le ghiandole, un dato a favore della tesi secondo cui le api scelgono quale polline raccogliere in base alla sua ricchezza.11
Questa scala di utilità del polline, tuttavia, non va misurata unicamente in base al contenuto proteico. Il polline ha infatti anche un’influenza sullo sviluppo della capacità immunitaria della api. Studi recenti che hanno messo in relazione la nutrizione a base di diversi tipi di polline con vari fattori che influenzano la capacità di resistenza alle malattie. Le api private di polline sviluppano molto meno sia il sistema immunitario individuale (relativamente poco importante per l’ape mellifera, rispetto alle api selvatiche) che soprattutto la risposta immunitaria della colonia nel suo complesso, che invece costituisce la principale barriera allo sviluppo e alla diffusione di malattie. Le diete con più tipi di polline hanno effetti positivi più marcati rispetto alle diete monopolliniche.12
Questo risultato difficilmente può dipendere solo dal contenuto proteico, per cui deve essere coinvolto qualche altro ingrediente del polline il cui ruolo non è ancora stato identificato. Sono stati effettuati studi anche su malattie specifiche, inoculando api in colonia o in gabbia con diversi patogeni ed esaminandone lo sviluppo in relazione al tipo di nutrimento. Il Nosema ceranae causa una mortalità precoce nelle api adulte, in qualsiasi modo siano nutrite. Diversi tipi di dieta, però, permettono di resistere più a lungo di altre: anche in questo caso, l’assenza di polline comporta la mortalità più precoce mentre il polline poliflorale è associato a una maggiore longevità. 13
Un esperimento simile è stato effettuato anche col Nosema apis: api in gabbia nutrite con una dieta pollinica sopravvivono mediamente circa 45 giorni senza nosema, mentre se sono infettate muoiono dopo poco più di 20 giorni. Api senza polline sopravvivono poco più di 20 giorni senza nosema, e circa 5 giorni meno se infette.
È interessante notare che in termini di durata di vita l’effetto della privazione di polline è paragonabile a quello del Nosema apis. 14 In esperimenti sul campo, però l’abbondanza o scarsità di polline non sembra aver influito sulla resistenza al Nosema: che le api abbiano avuto o meno abbondanza di polline (o di supplementi proteici) da larve non ha fatto differenza sulla mortalità tra api adulte sane e inoculate di Nosema apis. Gli autori suggeriscono che la differenza tra questo risultato e lo studio di api in gabbia potrebbe essere dovuta al fatto che il polline aggiuntivo, invece di essere assunto dalle api adulte, è stato usato per allevare le larve. 15
Un altro studio ha testato l’effetto della sospensione di poche ore della nutrizione pollinica sulla mortalità in caso di infezione di peste americana: 6 ore di privazione di polline (sostituite da dieta zuccherina) aumentano la mortalità delle larve infette dal 71 al 93–95%. 16
Anche la resistenza alla covata calcificata è positivamente influenzata da una dieta pollinica: Una alimentazione completa riduce immediatamente il grado di mortalità delle pupe; se si tolgono le scorte ma si lascia alle api la possibilità di ricostituirle, l’infezione dapprima sale ma quando entra polline diminuisce; mentre se le api sono mantenute in condizione di assenza di polline il grado di calcificazione resta significativamente più alto. 17
Il polline aiuta le api anche nei confronti della Varroa. L’acaro, quando si riproduce nelle cellette delle api, parassita la pupa privandola di parte del nutrimento, drenandone fino al 25%. Tanto maggiore è la riserva proteica, tanto meglio la pupa può diminuire i sintomi di carenza di proteine. 18
Va anche notato che carenze di polline allo stadio larvale interagiscono con gli attacchi della Varroa e hanno effetti cumulativi sulla perdita di peso delle api —perdita che non riesce ad essere recuperata neppure con somministrazioni successive di polline alle api adulte. 19
Inoltre una dieta pollinica per le larve attiva dei meccanismi cellulari che permettono alle api di riconoscere e metabolizzare meglio i nutrienti, contribuendo così ad inibire lo sviluppo delle virosi trasmesse dalle Varroe; anche in questo caso la somministrazione di polline alle api adulte non ha il medesimo effetto. 20
Abbondante presenza di polline aiuta anche le api a riconoscere ed eliminare le celle infette di Varroa, 21 e in generale si rileva che colonie con abbondanti risorse proteiche subiscono meno l’impatto della Varroa. 22
Un’alimentazione proteica aiuta le api anche a resistere meglio ai pesticidi: test su diversi tipi di pesticidi hanno mostrato che la mortalità è molto superiore per api malnutrite rispetto alle api con una dieta ricca di polline, 23 e in generale la mortalità di api in gabbia dipende dalla quantità e dal contenuto proteico del polline che le larve assumono. 24
Larve carenti di polline presentano più malformazioni e ovaie meno sviluppate, mentre se il deficit pollinico si present allo stadio adulto ovaie e massa toracica si sviluppano più lentamente. L’epitelio intestinale è indebolito, e il virus delle ali deformate è più concentrato in api nutrite senza proteine o con alimenti proteici che non nelle api nutrite con polline. 25
Anche i fuchi subiscono l’effetto di carenze polliniche allo stadio larvale: sono significativamente più leggeri, e in particolare hanno una minore massa toracica —dunque i loro muscoli alari sono meno sviluppati, il che ne riduce la capacità di volo; la loro capacità di eiaculare è inferiore a quella dei fuchi nutriti normalmente, e producono meno sperma, il che riduce la loro capacità riproduttiva. 26
Seppure gli studi citati qui riguardano aspetti specifici legati alla malnutrizione, il quadro generale che ne emerge —e sul quale sempre più autori richiamano l’attenzione— è quello dell’interazione tra le molteplici cause che contribuiscono al collasso delle colonie. Il problema della nutrizione non riguarda solo le api individuali ma l’intera colonia, e va dunque analizzato su tre livelli (v. immagine 27 ).
Le scorte a disposizione della colonia determinano la possibilità di nutrire le api adulte; queste (le nutrici, in particolare) sono poi incaricate di nutrire a loro volta le larve cercando di gestirne la popolazione in modo tale da garantirne la qualità a fronte delle fluttuazioni dell’ambiente esterno —se necessario anche cannibalizzando le larve giovani per permettere la maturazione di quelle più vecchie. Le larve costituiranno poi la generazione futura di operaie, che dipende dunque dal numero e dalla qualità delle larve allevate dalla generazione precedente. Ciò ha poi delle ripercussione sulla capacità di nutrire l’intera colonia, che dipende dal numero e dall’efficienza lavorativa delle api adulte.
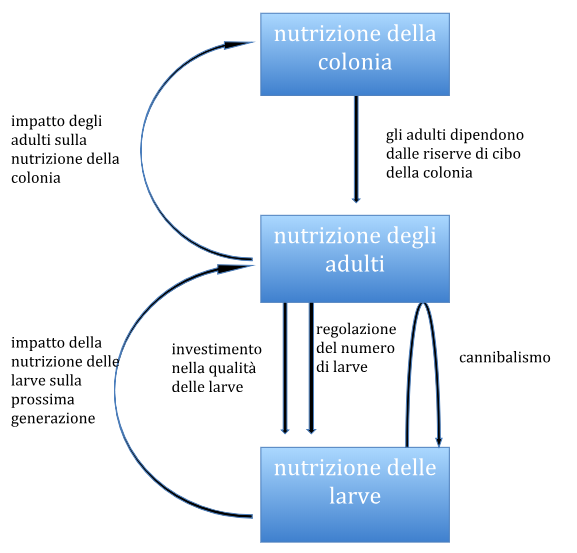
È dunque chiaro che problemi in uno qualsiasi di questi livelli sono destinati a ripercuotersi sugli altri livelli, per più generazioni. Se le difficoltà non sono gravi, possono essere riassorbite grazie a una certa elasticità nella divisione dei compiti e non pregiudicano il funzionamento della colonia. Può tuttavia darsi che i problemi legali alla nutrizione (che nascano dal maltempo o da una cattiva gestione degli apiari) interagiscano con patogeni e virosi, parassiti, pesticidi, predatori: abbiamo visto come, da un lato, la scarsità di polline possa favorire lo sviluppo o la gravità delle conseguenze di patologie anche serie e diminuisca la capacità di gestire i danni della varroa.
Ma l’insorgere di malattie —magari di per se gestibili dalle api—, gli attacchi di parassiti o predatori, i veleni usati in agricoltura e nel giardinaggio indeboliscono ulteriormente la famiglia, incidendo sulla sua capacità di nutrirsi, la quale a sua volta aumenta la mortalità delle larve, accorcia la vita delle api e le rende meno efficienti, causando così un’amplificazione dei problemi in un processo che può portare al collasso della colonia. 28 Per quanto, presi isolatamente, ciascuno degli effetti di una carenza alimentare possano sembrare di poco conto, nella loro interazione tendono ad accumularsi e possono portare a conseguenze catastrofiche.
Oggi si tende a pensare che non esista una sola causa del colasso delle colonie, caratterizzate da arnie che si trovano vuote senza che apparentemente sia successo nulla di particolare. In effetti cause relativamente piccole possono condurre a questo risultato proprio grazie alla loro interazione. L’alimentazione è un tassello importante in questo schema: la forza della colonia e la sua capacità di resistere alle variazioni ambientali dipende in modo essenziale dalla quantità e qualità del nutrimento a disposizione della colonia. Contro la meteorologia non possiamo fare gran che; ma possiamo ridurre il rischio di innescare questi meccanismi cumulativi gestendo gli apiari in modo da evitare di procurare alle api quegli stress nutrizionali di cui farebbero volentieri a meno.
- 1 Relazione presentata al convegno “Densità degli apiari e salute delle api”, organizzato dalla Sezione di Lugano della STA e tenutosi a Pregassona il 18 marzo 2018.
- 2 A. Imdorf, M. Rickli, V. Kilchenmann, S. Bogdanov e H. Wille, Nitrogen and mineral constituents of honey bee worker brood during pollen shortage. Apidologie 1998, vol. 29, pp. 315–325.
- 3 T. Schmickl & K. Crailsheim, How honeybees (Apis mellifera L.) change their broodcare behaviour in response to non-foraging conditions and poor pollen conditions, Behav Ecol Sociobiol 2002, vol. 51, pp. 415–425.
- 4 U. Riessberger e K. Crailsheim, Short-term effect of different weather conditions upon the behaviour of forager and nurse honey bees (Apis mellifera carnica Pollmann), Apidologie 1997, vol. 28, pp. 411–426..
- 5 T. Schmickl & K. Crailsheim, Cannibalism and early capping: strategy of honeybee colonies in times of experimental pollen shortages, J Comp Physiol A, 2001, vol. 187, pp. 541–547.
- 6 Imdorf e altri, 1998, citato; e T. Schmickl, B. Blaschon, B. Gurmann, e K. Crailsheim, 2003, Collective and individual nursing investment in the queen and in young and old honeybee larvae during foraging and non-foraging periods. Insect Soc. 2003, vol. 50, pp. 174–184.
- 7 S. F. Pernal e R. W. Currie, The influence of pollen quality on foraging behavior in honeybees (Apis mellifera L.), Behav Ecol Sociobiol 2001, vol. 51, pp. 53–68.
- 8 A. Weidenmüller e J. Tautz, In-hive behavior of pollen foragers (Apis mellifera) in Honey bee colonies under conditions of high and low pollen need, Ethology 2002, vol. 108: 3, pp. 205–221.
- 9 H. N. Scofield e H. R. Mattila, Honey bee workers that are pollen stressed as larvae become poor foragers and waggle dancers as adults, PLoS ONE 2015, vol. 10(4): e0121731.
- 10 E. Omar, A. A. Abd-Ella, M. M. Khodairy, R. Moosbeckehofer, K. Crailsheim e R. Brodschneider, Influence of different pollen diets on the development of hypopharyngeal glands and size of acid gland sacs in caged honey bees (Apis mellifera), Apidologie 2017, vol. 48, pp. 425–436; v. anche M. T. Renzi et al., Combined effect of pollen quality and thiamethoxam on hypopharyngeal gland development and protein content in Apis mellifera, Apidologie 2016, vol. 47, pp. 779–788; G. Di Pasquale, M. Salignon, Y. Le Conte, L. P. Belzunces, A. Decourtye et al. Influence of pollen nutrition on Honey bee health: Do pollen quality and diversity matter?, PLoS ONE 2013, vol. 8(8): e72016.
- 11 La questione è controversa. Uno studio recente conclude che il criterio di scelta non è legato direttamente alla presenza di aminoacidi, perché l’aggiunta di aminoacidi a pollini poveri non li rende più appetibili per le api: V. Corby-Harris, L. Snyder, C. Meador e T. Ayotte T, Honey bee (Apis mellifera) nurses do not consume pollens based on their nutritional quality, PLoS ONE 2018, vol. 13(1); v. anche I. Keller, P. FluriI e A. Imdorf, Pollen nutrition and colony development in honey bees, Bee World 2005, vol. 86, March & June.
- 12 C. Alaux, F. Ducloz, D. Crauser e Y. Le Conte, Diet effects on honeybee immunocompetence, Biol. Lett. 2010, vol. 6, pp. 562–565; Di Pasquale e altri, 2013 (citato sopra).
- 13 Di Pasquale e altri, 2013 (citato).
- 14 Z. Huang, Pollen nutrition affects honey bee stress resistance, Terrestrial Arthropods Review 2012, vol. 5, pp. 175–189.
- 15 H. R. Mattila e G. W. Otis, Effects of pollen availability and Nosema infection during the spring on division of labor and survival of worker Honey bees (Hymenoptera: Apidae), Environ. Entomol. 2006, vol. 35(3), pp. 708–717.
- 16 T. E. Rinderer, W. C. Rothenbuhler e T. A. Gochnauer, The influence of pollen on the susceptibility of honey-bee larvae to Bacillus larvae, J. Invertebr. Pathol. 1974, vol. 23, pp. 347–350.
- 17 J. M. Flores, I. Gutiérrez e R. Espejo, The role of pollen in chalkbrood disease in Apis mellifera: transmission and predisposing conditions, Mycologia, 2005, vol. 97:6, pp. 1171–1176.
- 18 A. F. Janmaat e M. L. Winston, Removal of Varroa jacobsoni infested brood in honey bee colonies with different pollen stores, Apidologie 2000, vol. 31, pp. 377–385.
- 19 C. van Dooremalen, E. Stam, L. Gerritsen, B. Cornelissen, J. van der Steen, F. van Langevelde et al., Interactive effect of reduced pollen availability and Varroa destructor infestation limits growth and protein content of young honey bees, J Insect Physiol. 2013, vol. 59, pp. 487–493.
- 20 C. Alaux, et al., Nutrigenomics in honey bees: digital gene expression analysis of pollen’s nutritive effects on healthy and varroa-parasitized bees. BMC Genomics 2011, vol. 12, pp. 496–509.
- 21 Janmaat & Winston, 2000 (citato).
- 22 F. A. Eischen, R. H. Grahamj, e R. Riveraj, Overwintering nutritionally stressed honey bee colonies infested with Varroa destructor. American Bee Journal 2008, vol. 148, pp. 555–556.
- 23 Wahl, O. and U. Kurt, Influence of pollen feeding and physiological condition on pesticide sensitivity of the honeybee Apis mellifera carnica, Oecologia 1983, vol. 59, pp. 106–128, riportato da Huang 2012 (citato).
- 24J. O. Schmidt, S. C. Thoenes e M. D. Levin, Survival of Honey bees, Apis mellifera (Hymenoptera: Apidae), fed various pollen sources, Ann. Entomol. Soc. Am., 1987, vol. 80, pp. 176–183.
- 25 G. de Grandi-Hoffman, Y. Chen, E. Huang, M. H. Huang, The effect of diet on protein concentration, hypopharyngeal gland development and virus load in worker honey bees (Apis mellifera L.), J. Insect Physiol. 2010, vol. 56 (9), pp. 1184–1191.
- 26 K. Czekonska, B. Chuda-Mickiewicz e J. Samborsky, Quality of honeybee drones reared in colonies with limited and unlimited access to pollen, Apidologie 2015, vol. 46, pp. 1–9.
- 27 Adattata da R. Brodschneider, K. Crailsheim, Nutrition and health in honey bees, Apidologie 2010, vol. 41, pp. 278–294.
- 28 A. G. Dolezal e A. L. Toth, Feedbacks between nutrition and disease in honey bee health, Current Opinion in Insect Science 2018, vol. 26.
